|
IMGT Web resources
|

|
Les Immunoglobulines (ou Anticorps)
Professeurs Marie-Paule LEFRANC et Gérard LEFRANC
Université Montpellier II et Laboratoire d'ImmunoGénétique Moléculaire,
LIGM, UPR CNRS 1142, Institut de Génétique Humaine,
141 rue de la Cardonille, 34396 Montpellier Cedex 5 (France)
Tel. : +33 (0)4 11 75 97 28 /+33 (0)4 11 75 97 29 - Fax : +33 (0)4 34 35 99 01
E-mail Marie-Paule.Lefranc@igh.cnrs.fr,
IMGT: http://www.imgt.org
SOMMAIRE
Introduction
I - Structure de base des immunoglobulines et leur double fonction
II - Chaînes lourdes et chaînes légères
III - Domaines variables et constants
1. Caractéristiques de base d'un domaine d'immunoglobuline
2. Nombre de domaines
3. Interface entre domaines
IV - Glycosylation
1. La N-glycosylation sur Asparagine (Asn, N)
2. La O-glycolysation sur Sérine (Ser, S) et Thréonine (Thr, T)
V - Immunoglobulines et évolution
VI - Immunoglobulines membranaires
1. Structure
2. Fonction d'une IG membranaire
3. Les différentes IG membranaires
VII - Immunoglobulines sécrétées
Introduction
Double rôle des immunoglobulines ou anticorps :
- reconnaissent des antigènes à la surface de corps étrangers tels que bactéries et virus ou
à la surface de cellules tumorales.
- interviennent dans les mécanismes d'élimination de ces corps étrangers et de ces cellules
tumorales: lyse cellulaire et/ou phagocytose.
I - Structure de base des immunoglobulines et leur double fonction
1. Les immunoglobulines sont formées de:
4 chaînes:
2 chaînes lourdes identiques de 50-70 kDa
2 chaînes légères identiques de 25 kDa
| QUESTION |
| Qu'est-ce qu'un kDa?
|
1 kDa=1,66x10-21g. Une chaîne de 1 kDa correspond approximativement à 8,42 acides aminés et
à 136 atomes (IMGT Aide Mémoire > Amino acid abbreviations, characteristics and hydropathy index).
2. Expériences de Porter 1959 : digestion d'IgG1 par la papaïne
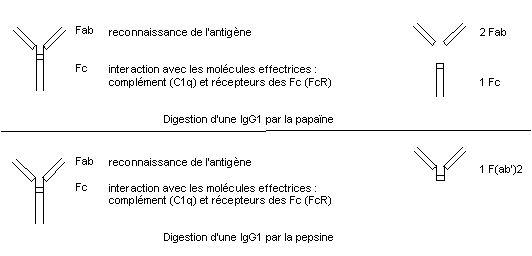
3. Interaction avec le Fc des anticorps

II - Chaînes lourdes et chaînes légères
- 5 classes d'immunoglobulines: IgM, IgD, IgG, IgA, IgE définies par les chaînes lourdes: mu, delta, gamma, alpha, epsilon.
- 2 types de chaînes légères: kappa et lambda partagées par toutes les classes et sous-classes.
- 4 sous-classes IgG (IgG1 à IgG4), 2 sous-classes IgA (IgA1 et IgA2).
- Au total 9 types de chaînes lourdes qui définissent les sous-classes ou isotypes: chaînes mu, delta, gamma 1 à 4, alpha 1 et 2, epsilon.
Chez l'homme, les chaînes légères kappa et lambda sont dans un rapport: kappa/lambda=2/1
III - Domaines variables et constants
1. Caractéristiques de base d'un domaine d'immunoglobuline
- domaine de 100-110 acides aminés
- pont disulfure intra-domaine
- feuillets beta anti-parallèles sur 2 plans (structure en "sandwich"), l'ensemble ayant une
structure 3D globulaire.
2. Nombre de domaines
Il y a 1 domaine variable V reconnaissant l'antigène à l'extrémité N-terminale de chaque chaîne lourde et légère.
Les 2 domaines V sont impliqués dans la reconnaissance spécifique des antigènes.
La partie de l'antigène
reconnue par l'anticorps est appelée épitote. La partie des domaines variables qui reconnaissent
l'épitope est appelée paratope.
Les autres domaines sont dits constants (C-KAPPA, C-LAMBDA pour les chaînes légères, CH1 à CH4 pour les chaînes lourdes).
| QUESTION |
Combien de domaines pour une chaîne légère? (2) 1V + 1C
Combien de domaines pour une chaîne lourde ? (4 ou 5) 1V + 3 ou 4 C |
Combien de domaines pour une IgG? (4V + 8C)
Combien de domaines pour une IgM? (4V+10C) |
| Quels sont ces domaines? |
3. Interface entre domaines
Relativement hydrophobe.
Les domaines ont des liaisons non covalentes (forces de Van der Waals, liaisons hydrogènes, rarement liaisons ioniques).
IV - Glycosylation
Les immunoglobulines sont des glycoprotéines (la glycosylation est une modification post-traductionnelle).
On distingue :
1. La N-glycosylation sur Asparagine (Asn , N)
L'enzyme reconnaît un motif NXS/T.
Les chaînes glucidiques des domaines CH2 occupent l'espace entre les 2 domaines CH2 qui se trouvent ainsi
éloignés l'un de l'autre (en général les chaînes glucosidiques des protéines sont plutôt exposées à la surface).
Glycosylation (IMGT Lexique)
2. La O-glycolysation sur Sérine (Ser, S) et Thréonine (Thr, T)
Pas de motif facilement identifiable.
Surtout au niveau de la région charnière des chaînes lourdes delta (des IgD) et alpha 1 (des IgA1).
| QUESTION |
Quel serait le rôle des chaînes glucidiques des IgA1?
|
IV - Immunoglobulines et évolution
- Les immunoglobulines (IG), les récepteurs T (TR) et les molécules du complexe majeur d'histocompatibilité
(CMH ou HLA chez l'homme pour human leukocyte antigen) sont des protéines essentielles de la réponse immunitaire
adaptative ou spécifique (dont les propriétés sont la "spécificité" des anticorps et des récepteurs T,
et la "mémoire" des lymphocytes B et T).
- Ces protéines n'existent que chez les Vertébrés à mâchoires (ou Gnathostomes).
Les espèces de vertébrés sans mâchoires (ou Agnathostomes) actuels,
Myxines et Lamproies, n'ont ni IG, ni TR, ni CMH.
VI - Immunoglobulines membranaires
1. Structure
Une immunoglobuline (IG) membranaire (ou mIg):
- est un monomère (formé de 2 chaînes lourdes et 2 chaînes légères).
- est ancrée dans la membrane cellulaire par les 2 chaînes lourdes.
2. Fonction d'une IG membranaire
- C'est un récepteur d'antigènes, spécifique ("antigen receptor").
- Elle est associée à des molécules corécepteurs (CD79A et CD79B) formées chacune d'un seul domaine Ig-like et associées en un hétérodimère.
- L'ensemble constitue le récepteur B (BcR).
- Ce sont les corécepteurs qui assurent la transmission du signal vers l'intérieur du lymphocyte B. La liaison d'un antigène à l'IG membranaire induit la phosphorylation de la région intracytoplasmique des corécepteurs et la cascade de signalisation qui conduit à l'activation des lymphocytes B.
3. Les différentes IG membranaires
- Les mIgM et mIgD sont à la surface des lymphocytes B immatures qui quittent la moelle osseuse et gagnent les organes lymphoïdes II (ganglions, rate)
- Les mIgG, mIgA et mIgE sont à la surface des lymphocytes B mémoires.
VII - Immunoglobulines sécrétées
- Les IgG , IgD et IgE sécrétées sont des monomères
- Les IgM sont des pentamères
- Les IgA sont principalement sous forme de monomères dans le plasma et de dimères dans les sécrétions séromuqueuses.
Created: 15/10/2003
Last updated: Friday, 22-Sep-2023 18:15:53 CEST
Author: Marie-Paule Lefranc
Editor: Céline Protat



